Scientific papers - Sammlung Queue
Eine weitere interessante Information aus der Studie “Long COVID: Association of Functional Autoantibodies against G-Protein-Coupled Receptors with an Impaired Retinal Microcirculation“, aus den vorherigen Beiträge:
“In-vitro-Daten zeigten einen Einfluss von α1-AAK und AT1-AAK auf die Mastzellmodulation [46], was ein klinisches Merkmal bei Patienten mit Long Covif (Mastzellaktivierung) ist.”
46 stellt die Quelle der Bibliographie dar, die folgende Studie:
Okruhlicova L., Morwinski R., Schulze W., Bartel S., Weismann P., Tribulova N., Wallukat G. Autoantikörper gegen G-Protein-gekoppelte Rezeptoren modulieren Herzmastzellen. Zelle Mol. Immunol. 2007; 4 : 127–133.
Diese Studie, in voller Form, als pdf-Datei, ist hier:
Kurz gesagt, diese Studie zeigt dass α1-AAK und AT1-AAK die Reifung und Degranulation von Mastzellen beeinflussen:
“The present study demonstrated immunohistochemically that the IgG-AABs against G-protein-coupled α1-adrenoceptor and angiotensin II AT1-receptor influence mast cell maturation and degranulation.”
LG
Eine deutsche Studie:
IL-1RA Antibodies in Myocarditis after SARS-CoV-2 Vaccination
https://www.nejm.org/doi/full/10.1056/NEJMc2205667
Autoantikörper gegen G-Protein-gekoppelte Rezeptoren modulieren Herzmastzellen
Zusammenfassung:
Es ist bekannt, dass die Dichte von Myokardmastzellen bei Erkrankungen wie Bluthochdruck, Ischämie-Reperfusion, Myokarditis und dilatative Kardiomyopathie höher ist, als bei Herzen ohne Herzpathologie.
Die Masrzellakkumulation wurde gleichzeitig von erhöhten zirkulierenden und intrakardialen Immunmediatoren begleitet.
So deuten die Daten darauf hin, dass Mastzellen eine wichtige Rolle bei der Regulation eines funktionellen Zustands des Myokards unter normalen, aber hauptsächlich pathophysiologischen Bedingungen spielen, wenn das Myokard den Prozess des strukturellen Umbaus durchläuft.
Mehrere Studien zeigten, dass die Mastzellmediatoren variable Funktionen besitzen und daher die Struktur der extrazellulären Matrix des Herzens beeinflussen können. Zum Beispiel, es wurde berichtet, dass Tryptase die Entwicklung einer interstitiellen Fibrose moduliert, ebenso Chymase kann zur Gewebefibrose beitragen und der Mediator TNF-α ist an der Induktion der Apoptose beteiligt.
Es wurde berichtet, dass mehrere Herzerkrankungen mit funktionellen IgG-Autoantikörpern (AAK) assoziiert sind, die gegen G-Protein-gekoppelte Rezeptoren gerichtet sind.
Wir stellten die Hypothese auf, dass das IgG-AAK gegen G-Protein-gekoppelte Rezeptoren Myokardmastzellen modulieren könnten.
Die vorliegende Studie zeigte, dass die IgG-AAK gegen G-Protein-gekoppelten α1-Adrenozeptor (α1-AR) und Angiotensin-II-AT1-Rezeptor (AT1-R) die Reifung und Degranulation von Mastzellen beeinflussen können.
Basierend auf diesen Erkenntnissen gehen wir davon aus, dass die Autoantikörper gegen G-Protein-gekoppelte Rezeptoren, durch die Modulation von Mastzelleigenschaften, eine Rolle bei der Pathogenese von Herzerkrankungen spielen könnten.
Agonistische Autoantikörper als Gefäßerweiternde (Vasodilatatoren) bei der orthostatischen Hypotension ein neuer Mechanismus
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3275920/
Zusammenfassung:
Orthostatische Hypotonie OH (niedriger Blutdruck im Stehen), allgemein definiert als Abfall des systolischen/diastolischen Blutdrucks von ≥ 20/10 mmHg innerhalb von 3–10 min nach dem Stehen.
Agonistische Autoantikörper sind gegen bestimmte autonome G-Protein-gekoppelte Rezeptoren (GPCR) mit mehreren kardiovaskulären Erkrankungen assoziiert, einschließlich Bluthochdruck, Kardiomyopathie, Myokarditis und Herzrhythmusstörungen, die alle einen unterschiedlichen Grad an assoziierter Orthostase aufweisen. Diese Autoantikörper werden auch in den Seren gesunder Probanden gefunden, jedoch im Allgemeinen in geringerer Häufigkeit und in niedrigeren Titern.
Für diese Studie wurde die OH als Abfall des systolischen Blutdrucks von > 20 mmHg oder des diastolischen Blutdrucks von > 10 mmHg und/oder eine geringere Abnahme des Blutdrucks mit einem damit verbundenen Anstieg der Herzfrequenz von > 15 spm definiert.
Wir haben unsere Beobachtung bestätigt und erweitert, dass eine Untergruppe von Patienten mit orthostatischer Hypotonie gefäßerweiternde Autoantikörper gegen β2AR und/oder M3R aufweist, die resistente Arteriolen erweitern. Obwohl es unwahrscheinlich ist, dass eine isolierte Vasodilatation (Gefäßerweiterung) die einzige Ursache für orthostatische Hypotonie ist, können diese Autoantikörper, wenn sie vorhanden sind, wichtige Mitschuldige an der komplexen kardiovaskulären Pathophysiologie von OH sein.
Wir haben bei 75 % (15 von 20) der Patienten mit signifikanter OH das Vorhandensein von Autoantikörpern gegen β2-adrenerge und/oder M3-muskarinische Rezeptoren festgestellt.
Von den 10 Patienten mit idiopathischer OH waren 3 positiv für β2AR-Antikörper, 7 waren positiv für M3R-Antikörper und 3 waren positiv für beide Antikörper.
Ein ähnlicher Prozentsatz an Antikörper-Positivität wurde bei den 10 diabetischen OH-Patienten beobachtet (β2AR-Antikörper: 4; M3R-Antikörper: 6; β2AR- und M3R-Antikörper: 2).
OH ist mit erhöhter Sterblichkeit verbunden, verursacht Stürze und Verletzungen, beeinträchtigt die Lebensqualität und erschwert die gleichzeitige Einnahme von Medikamenten. Jede pharmakologische oder endogen erzeugte autonome Vasodilatation, die den systemischen peripheren Widerstand einbezieht, wird bei empfindlichen Personen eine Orthostase verursachen oder akzentuieren.
Aktivierung von Autoantikörpern gegen G-Protein-gekoppelte Rezeptoren bei Narkolepsie Typ 1
https://helda.helsinki.fi/bitstream/handle/10138/329325/1_s2.0_S1389945720305384_main.pdf?sequence=1
Zusammenfassung:
Patienten mit Narkolepsie leiden unter schwerer Tagesschläfrigkeit, gestörtem Nachtschlaf und schlafbezogenen Halluzinationen. Es gibt zwei Untertypen.
Narkolepsie Typ 1 (NT1) ist gekennzeichnet durch Kataplexie, einen plötzlichen Verlust des Muskeltonus im Wachzustand.
Die Halluzinationen können visuell, auditiv oder taktil sein und beim Einschlafen oder Aufwachen auftreten.
NT1-Patienten leiden unter einer Vielzahl von autonomen Symptomen.
Schmerzen sind erwartungsgemäß ein recht häufiges Symptom bei NT1.
Die meisten Patienten mit NT1 waren positiv auf Nozizeptionsrezeptor-Autoantikörper und alle waren positiv für M2-Rezeptor-Autoantikörper. Die Hälfte der Patienten hatte mindestens eine schwache β2-adrenerger Rezeptor-Autoantikörpern-Aktivität.
Das Auftreten von Nozizeptionsrezeptor-AAK stärkt den Zusammenhang zwischen Narkolepsie Typ 1 und Schmerzen.
M2-R AAK können mit dem Auftreten von Kataplexie und darüber hinaus Halluzinationen bei Narkolepsie zusammenhängen, da sie in den gleichen Gehirnbereichen gefunden werden, die an diesen Symptomen beteiligt sind.
Der Zusammenhang zwischen NT1, autonomen Beschwerden und der vermuteten kardiovaskulären Morbidität könnte mit dem Auftreten von β2-AR-AAK in Verbindung gebracht werden.
Die Aktivierung von AAK gegen β2-AR soll theoretisch den kardialen und peripheren Sympathikus erhöhen, und überraschenderweise wurde die Prävalenz der Aktivierung von AAK gegen M2-R auch mit Tachyarrhythmien in Verbindung gebracht.
β2-AR ist ein GPCR, der hauptsächlich in glatten Muskelzellen der Atemwege exprimiert wird, die eine Bronchodilatation verursachen, aber auch in der glatten Gefäßmuskulatur, die eine Gefäßerweiterung verursacht, im Herzen positive inotrope und chronotrope Effekte (dh Erhöhung der Schlagfrequenz), in Gebärmutter und Blase eine Entspannung verursacht.
Die Aktivierung von β2-AR AAK, wurde zuvor mit vaskulärer Demenz und Alzheimer-Krankheit sowie dem chronischen Müdigkeitssyndrom (CFS) in Verbindung gebracht.
Agonistische Autoantikörper gegen den α1-adrenergen Rezeptor und den β2-adrenergen Rezeptor bei Alzheimer und vaskulärer Demenz
https://onlinelibrary.wiley.com/doi/10.1111/j.1365-3083.2012.02684.x
Zusammenfassung:
Wir zeigen zum ersten Mal das Vorhandensein von agonistischen Autoantikörpern (agAAK) gegen den α1-adrenergen Rezeptor (α1-AR) und β2-adrenergen Rezeptor (β2-AR) bei vielen Patienten mit mäßiger bis leichter Demenz vom Alzheimer und vaskulären Typ.
Unter den verschiedenen Demenzformen ist die Alzheimer-Krankheit (AD) die häufigste Ursache:
-es gibt eine genetische Form und
-mehrere Studien stützen die Vorstellung, dass vaskuläre Störungen die Hauptursache für sporadische, nicht-genetische AD sind.
Die zweithäufigste Form der Demenz bei älteren Erwachsenen ist die vaskuläre Demenz. Die Ursachen dieser Form der Demenz sind unterschiedliche, oft diffuse Störungen, die alle zu Gefäßläsionen führen. (Zum Beispiel, Menschen, die an einem ischämischen Schlaganfall litten, entwickelten eine Demenz mit einer viermal höheren Inzidenz als Kontrollpersonen.)
Häufig bestehen bei älteren Patienten AD und vaskuläre Demenz nebeneinander.
Es wurde gezeigt, dass agAAK, das mit dem α1-AR interagiert, Schäden am Gefäßsystem verursacht.
Für die vorliegende Studie wurde ein Kollektiv von 54 Patienten beiderlei Geschlechts mit leichten bis mittelschweren kognitiven Beeinträchtigungen aufgrund von AD/vaskulärer Demenz, aber ohne klinisch manifestierten Bluthochdruck, rekrutiert.
Die Mehrheit der positiven Patienten enthielt beide Arten von Autoantikörpern in Kombination.
In einer Kontrollgruppe von Patienten mit anderen neurologischen Beeinträchtigungen als Alzheimer und vaskulärer Demenz (Parkinson-Krankheit, Delirium und Alkoholmissbrauchssyndrome) wurde festgestellt, dass nur 17 % diese Autoantikörper beherbergen.
Zum Vergleich analysierten wir ein Kollektiv von 36 Patienten, die sich mit myokardialen Komplikationen in Behandlung befanden, aber keine Anzeichen von kognitiven Beeinträchtigungen aufwiesen. Keiner dieser Patienten war positiv für agAAK gegen den α1-AR oder den β2-AR.
Folglich können personalisierte therapeutische Strategien zur spezifischen Bekämpfung der Wirkung von agAAK eingesetzt werden. Es wurde gezeigt, dass Rezeptorantagonisten wirksam sind, um die Wirkung von agAAK aufzuheben und dadurch Endorganschäden zu verhindern. Antagonisten des α1-AR werden therapeutisch eingesetzt, beispielsweise bei der Behandlung der benignen Prostatahyperplasie. Sie zeigen jedoch vielfältige Nebenwirkungen.
Bei der Studie, die Identifizierung des Ziel-GPCR-Typs wurde unter Verwendung spezifischer Rezeptorantagonisten durchgeführt, Prazosin zum Blockieren des α1–AR. (Prazosin ist bekannt zur Behandlung von gutartiger Prostatahyperplasie.)
Der Nachweis des potenziell pathogenen agAAK kann einen wertvollen frühen Marker liefern, um das Risiko für Patienten abzuschätzen, AD/vaskuläre Demenz zu entwickeln.
Morbus Basedow (Graves Disease) nach SARS-CoV-2-Impfung: Eine systematische Überprüfung
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9501427/
Zusammenfassung:
Bei Patienten mit Graves Disease nach COVID-Impfung die häufigsten Symptome waren: Herzklopfen, Gewichtsverlust, distaler Tremor, Verhaltensstörungen, Schlafstörungen, Asthenie, Magen-Darm-Störungen, Fieber, Belastungsdyspnoe, Schwitzen, Hitzeintoleranz, Kopfschmerzen, Atemnot, Beinödeme, Zittern, Schwellung der Augenlider, gesteigerter Appetit.
Das Schilddrüsenprofil zeigte einen niedrigen TSH-Wert, normales oder erhöhtes fT4, und fT3- und TRAK-Wert (TSH-Rezeptor-Antikörper) über dem Normalbereich.
Gelegentlich wurden Antikörper gegen Schilddrüsenantigene Thyreoglobulin-Antikörper (TgAk) und Thyroperoxidase-Antikörper (TPOAk) gemessen.
Wenn verfügbar, zeigte die Halssonographie ein Bild einer weit verbreiteten Zunahme der Drüsengröße und Vaskularität, während die Aufnahme von radioaktivem Jod bei Schilddrüsenscan hoch war.
Angesichts der kurzen Beobachtungszeit dieser Patienten berichteten alle Autoren über die Gabe von Antithyreostatika (Thionamide) und Betablockern als initiale Therapie und Symptomkontrollstrategie für Schilddrüsenüberfunktion.
Adalimumab als potenzielle Behandlung des posturalen orthostatischen Tachykardiesyndroms (POTS)
https://www.sciencedirect.com/science/article/pii/S2214027120302414
Zusammenfassung
POTS kann klinisch durch Benommenheit, Herzklopfen, Zittern, Belastungsintoleranz oder allgemeine Müdigkeit definiert werden, die beim Aufstehen aus einer liegenden Position auftritt und zu einem Anstieg der Herzfrequenz von 30 Schlägen/min (40 Schläge/min im Alter von 12–19 Jahren) führt, ohne Abfall des systolischen Blutdrucks über 20 mm Hg.
75 % der Patienten sind weiblich.
Wir stellen eine Patientin mit POTS in der Anamnese vor, die sich einer Behandlung mit Adalimumab für eine seronegative ankylosierende Spondylitis (SAS) unterzogen hatte.
Interessanterweise verschwanden praktisch alle POTS-Symptome der Patientin nach Beginn der Behandlung mit Adalimumab.
Es wurde festgestellt, dass mehrere Erkrankungen, die derzeit mit Adalimumab behandelt werden, zufällig für das Medikament anfällig sind, da die Primärbehandlung einer Erkrankung zu unbeabsichtigten therapeutischen Nebenwirkungen bei einer anderen führte.
Dies ist hier der Fall, da die jahrelange Benommenheit, Müdigkeit, Herzklopfen, Dyspnoe und Schwäche unserer Patientin innerhalb von Monaten nach Beginn der Adalimumab-Therapie, gegen Gelenkschmerzen und Steifigkeit im Zusammenheit mit SAS, abgeklungen waren.
Die POTS-Symptome unserer Patientin waren gegenüber der traditionellen medizinischen Behandlung refraktär und blieben bis zum Beginn der Adalimumab-Pharmakotherapie für ihr SAS unbehandelt.
Ihr ursprünglicher Behandlungsplan für POTS umfasste sowohl Änderungen des Lebensstils als auch eine Pharmakotherapie. Sie wurde angewiesen, hydratisiert zu bleiben und die Salzaufnahme zu erhöhen, fand aber keines davon hilfreich. Ihr wurde auch Propranolol verschrieben 10 mg zweimal täglich, was unwirksam war. Tatsächlich berichtete sie von niedrigem Blutdruck und sich verschlechternder Tachykardie. Außerdem wurden ihr Kompressionsstrümpfe verschrieben, die sie jedoch aufgrund eines deutlichen Kribbelns in den unteren Extremitäten und eines erhöhten Druckgefühls um den Kopf schnell wieder absetzte.
Im Serum einiger Patienten mit POTS zeigte eine Studie das Vorhandensein von Antikörpern gegen den α1-adrenergen Rezeptor (α1AR). Diese Antikörper üben eine teilweise antagonistische Wirkung gegen die periphere vasokonstriktive Kompensation der Orthostase aus. Darüber hinaus wurden auch β1AR- und β2AR-agonistische Autoantikörper gefunden, die die Tachykardie fördern. Diese Befunde sind bei Patienten mit POTS nicht ungewöhnlich. Es hat sich gezeigt, dass die überwiegende Mehrheit der POTS-Patienten ein Serum hat, das mindestens 1 adrenergen G-Protein-gekoppelten Rezeptor-Antikörper enthält.
Adalimumab ist ein humaner monoklonaler Antikörper gegen den Tumornekrosefaktor (TNF)-alpha.
Da vermutet wird, dass die autoimmune Natur von POTS mit adrenergen Autoantikörpern zusammenhängt, ist es möglich, dass die vorgeschaltete Hemmung von TNF-alpha die Aktivität dieser Antikörper verändert und die Entzündungsreaktion abschwächt, die Symptome auslöst.
(Ergänzung: gut zu wissen dass es auch vielen naturlichen TNF blockers geben, im Internet finden sich einfach einige Listen von NEM's.)
LG
Rezeptor-aktivierende Autoantikörper und Krankheit: Präeklampsie und andere
https://www.tandfonline.com/doi/full/10.1586/eci.11.56
Zusammenfassung:
Die hier besprochene Forschung befasst sich mit Autoimmunerkrankungen, bei denen die Krankheitspathologie aus der Anwesenheit von Autoantikörpern resultiert, die Zelloberflächenrezeptoren der GPCR-Familie (G protein-coupled receptors) aktivieren.
Morbus Basedow (Graves Disease)
Morbus Basedow war die erste Autoimmunerkrankung, die durch das Vorhandensein von rezeptoraktivierenden Autoantikörpern gekennzeichnet war.
Die Erkrankung resultiert aus dem Vorhandensein von Autoantikörpern (TSH- Rezeptor-Antikörpern, TRAK), die den Schilddrüsen-stimulierenden Hormonrezeptor (TSHR) aktivieren.
TSHR wird normalerweise aktiviert durch das Schilddrüsen-stimulierende Hormon TSH, ein Produkt der Hypophyse, das die Produktion und Sekretion von Schilddrüsenhormonen aus der Schilddrüse reguliert.
Die Basedow-Krankheit ist eine relativ häufige Autoimmunerkrankung, die durch diffuse Schilddrüsenvergrößerung, Herzklopfen, Muskelermüdung, Zittern und Angst gekennzeichnet ist und zusammenfassend als „Hyperthyreose“ bezeichnet wird.
Die Behandlung der Basedow-Krankheit mit Rituximab, einem B-Zell-depletierenden monoklonalen Antikörper, reduziert spezifisch die Produktion von TSHR-Antikörpern (TRAK).
β1-adrenerge Rezeptor-agonistische Autoantikörper und die Pathogenese der dilatativen Kardiomyopathie
Die dilatative Kardiomyopathie (DCM) ist eine Herzmuskelerkrankung, die durch einen fortschreitenden Verlust der Herzfunktion gekennzeichnet ist, der mit einer Dilatation des linken Ventrikels einhergeht.
In etwa 60 % der Fälle ist die Ätiologie unbekannt und der Zustand wird als idiopathische DCM bezeichnet. Die Erkrankung ist die Hauptursache für schwere Herzinsuffizienz und Behinderung bei jungen Erwachsenen.
DCM ist auch weit verbreitet bei Menschen mit der Chagas-Krankheit, eine endemische parasitäre Krankheit in Lateinamerika.
Seren von Patienten mit Kardiomyopathie der Chagas-Krankheit IgG enthalten, das β1-adrenerge Rezeptoren des Herzens bindet und die kontraktile Aktivität des Myokards stimuliert.
Nachfolgende Studien zeigten, dass diese β 1-adrenergen Rezeptor-Autoantikörper nicht auf die Chagas-Kardiomyopathie beschränkt waren, sondern häufig bei Personen mit idiopathischer DCM vorhanden waren.
Es gibt jetzt beträchtliche Beweise dafür, dass agonistische Autoantikörper, die auf den kardialen β1-adrenergen Rezeptor abzielen, mit einer DCM assoziiert sind und zur Krankheitspathologie beitragen.
Agonistische Autoantikörper gegen den β1-AR wurden bei etwa 70 % der Patienten mit DCM und etwa 20 % der Patienten mit ischämischer Kardiomyopathie beobachtet.
Das β1-adrenerger Rezeptor ist ein Mitglied der Superfamilie der GPCRs, deren Hauptfunktion im Herzen darin besteht, die Schlagfrequenz und -stärke positiv zu regulieren. Diese β1-Rezeptoren sind auch der vorherrschende Adrenozeptor-Subtyp im Herzen.
Autoantikörper (AAK) aktivieren die β1-AR-Signalkaskade und sind mit einer schlechten linksventrikulären Funktion, einer höheren Prävalenz schwerer ventrikulärer Arrhythmien und einer höheren Inzidenz von plötzlichem Tod verbunden.
Funktionell aktive (dh stimulierende) β1-AR-AAK sind in weniger als 1 % einer Population gesunder Individuen vorhanden.
Chagas-Krankheit
Die Chagas-Krankheit ist eine endemische parasitäre Erkrankung der lateinamerikanischen Länder und wird durch eine Infektion mit dem Protozoon Trypanosoma cruzi verursacht.
Nach einer langen Latenzzeit von 10–30 Jahren entwickeln fast 30 % der Infizierten lebensbedrohliche Kardiomyopathien, die mit Arrhythmien, Herzversagen und häufig plötzlichem Tod einhergehen.
Neue Beweise deuten auf einen Autoimmunbeitrag zur Chagas-Pathophysiologie hin, insbesondere zur Chagas-Herzkrankheit. Fast alle Chagas-Patienten mit Kardiomyopathie haben agonistische Autoantikörper gegen kardiale GPCRs, einschließlich β1-AR, β2-AR und der M2-Muskarinrezeptor.
Diese Autoantikörper fehlen bei nicht infizierten Kontrollpersonen und sind bei etwa 30 % der asymptomatischen, mit Trypanosoma cruzi infizierten Personen, vorhanden.
Zahlreiche Studien deuten darauf hin, dass β1-AR-AAK wie bei idiopathischer DCM zur Chagas-Herzkrankheit beitragen. Beide Patientengruppen tragen einen hohen Prozentsatz an β1-AR-AAK und die Übertragung von β1-AR-AAK auf Versuchstiere führte zu einer dilatativen Kardiomyopathie, ähnlich der beim Menschen beobachteten.
Es wurde für Patienten mit DCM gezeigt und für Patienten mit Chagas-Kardiomyopathie vorgeschlagen, dass die Entfernung dieser pathogenen Autoantikörper zu einem signifikanten klinischen Nutzen führen würde. Diese Autoantikörper können als präsymptomatische Marker dienen, um Patienten mit einem Risiko für die spätere Entwicklung einer Chagas-Kardiomyopathie zu identifizieren.
α1-adrenerge Rezeptor-aktivierende Autoantikörper und refraktärer Bluthochdruck
Neue Erkenntnisse weisen darauf hin, dass Autoantikörper, die in der Lage sind, α1-adrenerge Rezeptoren zu aktivieren, zu refraktärer Hypertonie (Patienten die drei oder mehr hypertensive Medikamente benötigen) und Kardiomyopathie beitragen.
Der potenzielle Beitrag von α1-AR-AAK zur Hypertonie wurde durch die Verwendung von Immunadsorption getestet, um diese Antikörper von Patienten mit refraktärer Hypertonie zu entfernen. Die Ergebnisse zeigten, dass die pathologischen Autoantikörper erfolgreich von den behandelten Patienten entfernt wurden und nach 5 Tagen Immunadsorption den normalen Bereich erreichten. Die reduzierte α1-AR-AAK-Aktivität hielt über den 180-Tage-Zeitraum des Versuchs an. Blutdruckmessungen zeigten eine signifikante Verringerung des mittleren arteriellen Drucks nach 5 Tagen und blieben während des 180-tägigen Beobachtungszeitraums niedrig. Diese Ergebnisse legen nahe, dass α1-AR-AAK sind von potenzieller pathophysiologischer Relevanz und können zur Entwicklung einer refraktären Hypertonie beitragen.
Angiotensinrezeptor-aktivierende Autoantikörper & Präeklampsie
Präeklampsie ist eine lebensbedrohliche Schwangerschaftskomplikation, die im Allgemeinen nach der 20. Schwangerschaftswoche auftritt und durch Hypertonie, Proteinurie, Entzündung, Gerinnselneigung gekennzeichnet ist und oft mit einer intrauterinen Wachstumsretardierung einhergeht.
Zahlreiche Studien haben gezeigt, dass Frauen mit Präeklampsie Autoantikörper besitzen, die auf vielen Zelltypen an den wichtigsten Angiotensin-II-Rezeptor (AT1R ) binden und ihn aktivieren.
Die Aktivierung von AT1 -Rezeptoren kann auch zur Hyperkoagulation beitragen, die häufig mit Präeklampsie einhergeht.
In Tiermodelle mit reduziertem uterinen Perfusionsdruck (RUPP), die Behandlung von Tieren mit Rituximab, um die Mobilisierung von B-Lymphozyten zu verhindern, hemmte die Produktion von AT1-AAK und reduzierte den Bluthochdruck. RUPP-induzierter Bluthochdruck wurde durch Losartan gehemmt, aber nicht durch einen ACE-Hemmer, was darauf hindeutete, dass AT1-AAK zu dem in diesem Tiermodell für Präeklampsie beobachteten Bluthochdruck beitragen.
Die Verwendung von ELISAs zum Nachweis von AT1-AAK bei Patienten mit Präeklampsie wurde berichtet, um die Nützlichkeit als präsymptomatischer Test zu bestimmen.
Die Rolle von AT1-AAK bei der vaskulären Abstoßung von renalem Allotransplantat
Eine Analyse von Nierentransplantatempfängern ergab eine grobe Prävalenz von AT1-AAK-assoziierten vaskulären Abstoßungsepisoden.
Diese Ergebnisse legen nahe, dass betroffene Patienten von der Entfernung der pathogenen Autoantikörper oder der Blockade von AT1Rs oder beidem profitieren können.
Mehrere AT1-AAK-positiven Patienten wurden mit einer Kombinationstherapie behandelt, die aus Plasmapherese, intravenösen Immunglobulin-Infusionen und dem AT1R-Blocker Losartan bestand. Dieses Behandlungsschema führte zu einer verbesserten Nierenfunktion und Transplantatüberlebensdauer.
Funktionelle Autoantikörper gegen vaskuläre Rezeptoren bei systemischer Sklerose
Systemische Sklerose (SSc) ist eine chronische systemische Autoimmunerkrankung (hauptsächlich der Haut), die durch Fibrose, Gefäßveränderungen und Autoantikörper gekennzeichnet ist.
AT1-Rezeptor-aktivierende Autoantikörper sowie Autoantikörper, die den Endothelin-1-Rezeptor (ETAR) aktivieren, werden häufig bei Personen beobachtet, bei denen systemische Sklerose diagnostiziert wurde.
ETAR-aktivierende Autoantikörper & pulmonale arterielle Hypertonie
Die überwiegende Mehrheit der Patienten mit idiopathischer pulmonaler arterieller Hypertonie wurde positiv auf agonistische Autoantikörper gegen den ETAR und/oder die α1-adrenergen Rezeptoren getestet. Anfängliche Bemühungen, diese pathogenen Autoantikörper durch Immunadsorption zu entfernen, zeigten kurzfristig ermutigende Ergebnisse.
Schlussfolgerung
Rezeptor-aktivierende Autoantikörper stellen potenzielle präsymptomatische Marker und therapeutische Angriffspunkte für die medizinische Behandlung von Herz-Kreislauf-Erkrankungen dar, an denen rezeptor-aktivierende Autoantikörper beteiligt sind.
Diese Studien zeigten jeweils, dass es möglich war, pathogene Autoantikörper mit daraus resultierendem therapeutischem Nutzen, effektiv zu entfernen. Diese Studien liefern vielversprechende Hinweise darauf, dass die therapeutische Entfernung von Autoantikörpern, die pathogene Rezeptoren aktivieren, einen erheblichen klinischen Nutzen haben kann. In diesen Fällen ist auch eine medikamentöse Intervention mit spezifischen Rezeptorantagonisten sinnvoll.
@isabelle vielen Dank für die Info
Es macht mich stutzig 🤔 die Veröffentlichung war 2014...
...wenn dann heute unsere Ärzte über AAK nichts wissen bzw überfordert sind, KK Behandlungen nicht bezahlen, frag ich mich ernsthaft für was es dann solche Studien gibt....
Ich bin mehr als 1000 Tage krank. Seit März '21 ist alles anders,LymeBorreliose durch 1.AZ Impfung reaktiviert - 3x Antibiotika von März bis November 2021. Booster mit Biontec mit der Hoffnung MRNA ist besser. Fettleber und massive Fatigue. Seit mehr als 30 Monaten PVS. Zoster und EBV hoch aktiv im Blut nachgewiesen. AAK kardiovaskulär und Entzündungsmarker trotz CortisonStoßtherapie....Pflegegrad und GdB....
Vernetzt Euch ❗️Sucht euch eine SHG ❗️
#postvacnetzwerk auf Instagram ❗️
❗️https://www.info-coverse.com/ich-benoetige-hilfe/
Wir müssen zusammen gegen das Unrecht was uns angetan wurde kämpfen ❗️
Im Forum, zum Thema Autoantikörper, wurde bereits ein Link für eine sehr vollständige Auflistung von agonistischen Autoantikörpern und den Krankheiten, mit denen sie korrelieren, bereitgestellt:
Ich dachte, dass es ein wenig mehr Daten über diese Autoantikörper interessant sein könnte und es gibt viele Studien über sie im Internet, es gibt ziemlich viele, für alle zur Verfügung.
Daher denke ich, dass einige Ideen, die aus den oben genannten Studien gezeigt werden konnten, gut zu wissen sind, zum Beispiel, dass diese Autoantikörper Marker sein können, die die weitere Entwicklung einiger Krankheiten anzeigen könnten.
So kann zum Beispiel jemand, der β2-Autoantikörper hat, aus Vorsicht, eine häufigere Kontrolle des Augeninnendrucks für eine mögliche Veranlagung für Glaukom durchführen.
Oder: “Die Aktivierung von AT1-Rezeptoren kann auch zur Hyperkoagulation beitragen.” – man könnte mit Ärzten darüber sprechen, vielleicht ist es sinnvoll, zum Beispiel eine Prävention mit ASS zu machen.
Es sind nur Annahmen, aber sie sind gerechtfertigt.
Der Nutzen, an den ich für diese Studien gedacht habe, ist unter anderem, dass diejenigen, die Dokumente für Autoantikörper haben, die behandelnden Ärzte um mehr Aufmerksamkeit und Unterstützung bitten könnten, mit den objektiven Argumenten, die diese Studien bieten.
Und sind Daten, mit denen argumentiert werden kann, dass die Leiden nicht aus psychischen Ursachen entstehen.
Ich habe auch die Paragraphe reproduziert, in denen es andere Therapien als die Immunabsorption gab, weil ihre Verwendung diskutiert werden konnte, zum Beispiel mit Rheumatologen, Kardiologen.
Es ist wahr, dass die Immunabsorption nicht bei allen Menschen, die sie durchgeführt haben, eine besonders hohe Effizienz gezeigt hat, daher kann es sein, dass diese Autoantikörper nicht wichtiger sind, als andere pathologische Phänomene, die am Auftreten von Nebenwirkungen beteiligt sein können.
Auch wird auf dem Forum der Fall von @Aron, zu dem Laboruntersuchungen das spontane Verschwinden von Autoantikörpern gezeigt haben, mit der Remission von Symptomen und deren Rezidiv, bei einem durch eine Infektion verursachten Rückfall:
Das zeigt, dass es eine wirksamere Therapie wäre, die die Produktion von Autoantikörpern verhindern könnte, nicht diejenige, die sie reinigt oder ihre Wirkung blockiert.
Deutschland ist das Land, das führend in der Erforschung agonistischer Autoantikörper ist, also ist es vielleicht interessant in diesen Studien, wer sie durchgeführt hat, vielleicht können diese Forscher, netterweise, gebeten werden, ihre Forschung fortzusetzen oder mehr Informationen zur Verfügung zu stellen.
LG
Liebe @isabelle, immer wieder vielen lieben Dank für deine Ausführungen, die uns im Zusammenhang mit dem Dialog zwischen uns und unseren Ärzten weiter bringt.
LG und einen schönen Start ins Wochenende
Ich bin mehr als 1000 Tage krank. Seit März '21 ist alles anders,LymeBorreliose durch 1.AZ Impfung reaktiviert - 3x Antibiotika von März bis November 2021. Booster mit Biontec mit der Hoffnung MRNA ist besser. Fettleber und massive Fatigue. Seit mehr als 30 Monaten PVS. Zoster und EBV hoch aktiv im Blut nachgewiesen. AAK kardiovaskulär und Entzündungsmarker trotz CortisonStoßtherapie....Pflegegrad und GdB....
Vernetzt Euch ❗️Sucht euch eine SHG ❗️
#postvacnetzwerk auf Instagram ❗️
❗️https://www.info-coverse.com/ich-benoetige-hilfe/
Wir müssen zusammen gegen das Unrecht was uns angetan wurde kämpfen ❗️
Achtung: noch nicht ge-peer-reviewed -- betrachtet das also mit der gebotenen Vorsicht
Association of viral variant and vaccination status with the occurrence of symptoms compatible with post-acute sequelae after primary SARS-CoV-2 infection
Christian R. Kahlert, Carol Strahm, Sabine Güsewell, Alexia Cusini, Angela Brucher, Stephan Goppel, J. Carsten Möller, Manuela Ortner, Markus Ruetti, Reto Stocker, Danielle Vuichard-Gysin, Ulrike Besold, Allison McGeer, Lorenz Risch, Andrée Friedl, Matthias Schlegel, Pietro Vernazza, Stefan P. Kuster, Philipp Kohler, SURPRISE Study Group
doi: https://doi.org/10.1101/2022.10.21.22281349
vorab-veröffentlicht am 22. Oktober auf medRxiv
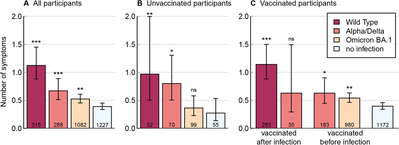
Die (fast ausschließlich Schweizer) Autoren beschreiben eine große Studie über Post-Covid-Symptome von fast 3000 Beschäftigen im Schweizer Gesundheitswesen. Zwischen Juli 2020 und Juni 2022 wurden die Probanden kontinuierlich bzgl. Infekten / PC-Symptomen / PC-Schweregrad / PC-Dauer / Impfstatus befragt und Antikörper untersucht. Der Patienten-Pool ist dafür m.E. gut gewählt (großer Anteil an gebärfähigen Frauen mit Stress im Beruf) und zu Beginn der Studie wurden nur Teilnehmer zugelassen bei denen noch keine Infektion nachgewiesen werden konnte.
Gemessen wurden daneben persönliche Kennzahlen (wie Alter, Haushaltsgröße, Kontakte zu Covid-Patienten, Allergien, ... ). Die Auswertungen zeigen Unterschiede zu Post-Covid bzgl. der am wahrscheinlichsten durchgemachten Virusvariante und dem Impfstatus. Besonders interessant ist, dass sie auch Post-Covid für nicht-Infizierte auswerten und das sogar zusammenbringen mit deren Impfstatus.
Ein leichter Schutz vor Post-Covid sei demnach durch Impfung für die Alpha/Delta-Variante gegeben, nicht jedoch für die Omikron-Variante. (Vorsicht bei der Interpretation zum Wildtyp: die Ungeimpften des Wildtyps stehen nicht deswegen besser da, weil sie zum Zeitpunkt der Infektion wie alle ungeimpft waren, sondern es ist wohl eher so, dass sie sich aufgrund fehlender Beschwerden einfach nicht mehr haben impfen lassen.) Diesen Plot lese ich allerdings auch so, dass die Impfung für nicht-Infizierte eine erhöhte Post-Covid-Anfälligkeit bedeutet. Das kann natürlich sonst was bedeuten: Personen, die anfälliger für PC sind, sind u.U. eher bereit dazu sich impfen zu lassen, bzw. sind ausgesprochene Impfgegner möglicherweise weniger dazu bereit PC-Symptome zu melden.
Sie haben weiterhin den Effekt des Boosters untersucht (same: hilft bei Alpha/Delta, weniger bei Omikron). Außerdem wurde nach weiteren statistischen Zusammenhängen in den Studiendaten gesucht. Eine erhöhtes Risiko für Post-Covid hat demnach wer einen erhöhten BMI, Vorerkrankungen oder irgendeine Medikation aufweist, außerdem ist das generelle Risiko höher für Infektionen mit Wildtyp und Alpha/Delta.
Was mir hier fehlt ist eine Aufschlüsselung der Daten nach Schwergrad oder nach Symptomen oder Re-Infektion. Auch eine genaue Definition was ein entsprechendes Symptom ist und wie lange es anhalten muss um gewertet zu werden, konnte ich nicht finden. Ich bin gespannt, ob sie das für ein Accept noch nachreichen, oder ob sie sich das für Folge-Veröffentlichung aufheben. Eine Aufschlüsselung möglicher Post-Vax-Opfer erwarte ich in diesem Rahmen nicht, aber auch das wäre für uns sehr interessant.
w, 39, 2x Moderna (Jul+Aug '21)
seit 1. Impfung anhaltende Myalgien, erhöhte Verletzungsanfälligkeit, eingeschränkte Belastbarkeit
seit 2. Impfung in Schüben Parästhesien und Palpitationen, Raynaud-Syndrom
Covid-Infekt Feb '22
Symptome quasi ohne Besserung; permanent Schwindel und Muskelschmerzen
@b-a-f-h 🤔tja, was wenn die Immunantwort zeitnah hyperreagiert ?
Ist von mir nur theoretisch eine Gegenargumentation, weil ich so etwas in meiner Ablehnung auch schon gelesen habe. Könnte, vermutlich, wahrscheinlich....
Ich bin mehr als 1000 Tage krank. Seit März '21 ist alles anders,LymeBorreliose durch 1.AZ Impfung reaktiviert - 3x Antibiotika von März bis November 2021. Booster mit Biontec mit der Hoffnung MRNA ist besser. Fettleber und massive Fatigue. Seit mehr als 30 Monaten PVS. Zoster und EBV hoch aktiv im Blut nachgewiesen. AAK kardiovaskulär und Entzündungsmarker trotz CortisonStoßtherapie....Pflegegrad und GdB....
Vernetzt Euch ❗️Sucht euch eine SHG ❗️
#postvacnetzwerk auf Instagram ❗️
❗️https://www.info-coverse.com/ich-benoetige-hilfe/
Wir müssen zusammen gegen das Unrecht was uns angetan wurde kämpfen ❗️
@b-a-f-h mein Immunsystem wurde durch die Impfung massiv getriggert und Borreliose ist aktiviert. Trotz allen zeitnahen Beweisen heißt es : Könnte sein, vermutlich aber eine LongCovid Symptomie, obwohl ich nie C positiv war...
Ich bin mehr als 1000 Tage krank. Seit März '21 ist alles anders,LymeBorreliose durch 1.AZ Impfung reaktiviert - 3x Antibiotika von März bis November 2021. Booster mit Biontec mit der Hoffnung MRNA ist besser. Fettleber und massive Fatigue. Seit mehr als 30 Monaten PVS. Zoster und EBV hoch aktiv im Blut nachgewiesen. AAK kardiovaskulär und Entzündungsmarker trotz CortisonStoßtherapie....Pflegegrad und GdB....
Vernetzt Euch ❗️Sucht euch eine SHG ❗️
#postvacnetzwerk auf Instagram ❗️
❗️https://www.info-coverse.com/ich-benoetige-hilfe/
Wir müssen zusammen gegen das Unrecht was uns angetan wurde kämpfen ❗️
Letzter Beitrag: Neurothread -> Ausschließlich neurologische Beschwerden!! Unser neuestes Mitglied: Chilly-007 Neueste Beiträge Ungelesene Beiträge Schlagwörter
Forum Icons: Das Forum enthält keine ungelesenen Beiträge Das Forum enthält ungelesene Beiträge
Themen-Icons: Unbeantwortet Beantwortet Aktiv Heiß Oben angepinnt Nicht genehmigt Gelöst Privat Geschlossen